La electroquímica es una rama de la fisicoquímica que se enfoca en el estudio de las reacciones de reducción-oxidación (redox) que implican la transferencia de electrones entre moléculas. Exploraremos la definición de la electroquímica, sus conceptos básicos y sus diversas aplicaciones en la industria, la tecnología y la medicina.
Conceptos básicos de electroquímica
Reacciones de reducción-oxidación (redox)
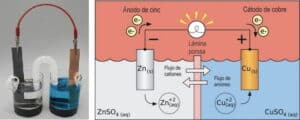
Las reacciones de reducción-oxidación, también conocidas como reacciones redox, son procesos químicos en los que ocurre una transferencia de electrones entre especies químicas. En una reacción redox, una especie química se oxida al perder electrones, mientras que otra especie se reduce al ganar electrones. Estas reacciones son fundamentales en la electroquímica, ya que implican la generación de electricidad mediante la transferencia de electrones.
Electrodo
Un electrodo es el extremo de un conductor eléctrico que está en contacto con un medio y permite recibir o transmitir una corriente eléctrica. En el contexto de la electroquímica, los electrodos son fundamentales, ya que son los sitios donde ocurren las reacciones redox. Un electrodo puede ser de dos tipos: ánodo y cátodo. El ánodo es el electrodo donde ocurre la oxidación, mientras que el cátodo es el electrodo donde se produce la reducción.
Electrolito
Un electrolito es una sustancia sometida a electrólisis, es decir, a un proceso de descomposición en iones provocado por la corriente eléctrica. En el contexto de la electroquímica, el electrolito es una solución que permite el flujo de iones entre los electrodos. Los iones en el electrolito son fundamentales para mantener la neutralidad eléctrica en la celda electroquímica y permitir la transferencia de electrones.
Historia de la electroquímica
Descubrimiento de la pila voltaica
La historia de la electroquímica se remonta al descubrimiento de la pila voltaica por Alessandro Volta en 1800. La pila voltaica fue la primera fuente de electricidad constante generada mediante reacciones químicas. Consistía en una serie de discos de zinc y cobre separados por discos de cartón empapados en una solución salina. Esta invención sentó las bases para el estudio de la generación de electricidad mediante reacciones químicas.
Leyes fundamentales de la electroquímica
En la década de 1830, Michael Faraday formuló las leyes fundamentales de la electroquímica. Estas leyes establecen la relación cuantitativa entre la cantidad de electricidad que pasa a través de una solución electrolítica y las reacciones químicas en los electrodos. Las leyes de Faraday son fundamentales para comprender y controlar las reacciones electroquímicas.
Aplicaciones de la electroquímica
Industria y tecnología
La electroquímica ha encontrado numerosas aplicaciones prácticas en la industria y la tecnología. Algunas de estas aplicaciones incluyen:
- Galvanización: La galvanización es un proceso electroquímico que se utiliza para recubrir objetos metálicos con una capa de otro metal, como el zinc o el cromo. Este proceso se utiliza para proteger los objetos metálicos contra la corrosión y mejorar su apariencia estética.
- Obtención de aluminio: La obtención de aluminio mediante electrólisis es otro ejemplo de aplicación de la electroquímica en la industria. El proceso de obtención de aluminio a partir de la bauxita utiliza grandes cantidades de energía eléctrica y es uno de los principales consumidores de energía en la industria del aluminio.
- Electrónica: La electroquímica también tiene aplicaciones en la fabricación de dispositivos electrónicos, como baterías recargables y celdas solares. Estos dispositivos utilizan reacciones electroquímicas para almacenar y generar energía eléctrica de manera eficiente.
Energía
La electroquímica desempeña un papel fundamental en el campo de la energía. Algunas de las aplicaciones de la electroquímica en el ámbito energético incluyen:
- Baterías recargables: Las baterías recargables son dispositivos electroquímicos que almacenan energía química y la liberan en forma de energía eléctrica cuando se conectan a un circuito. Estas baterías son ampliamente utilizadas en dispositivos electrónicos portátiles, vehículos eléctricos y sistemas de almacenamiento de energía renovable.
- Celdas de combustible: Las celdas de combustible son dispositivos electroquímicos que generan electricidad a partir de la reacción entre un combustible y un oxidante. Estas celdas son una alternativa prometedora a los motores de combustión interna, ya que producen electricidad de manera más eficiente y con menos emisiones de gases contaminantes.
Medicina
La electroquímica también tiene aplicaciones en el campo de la medicina. Algunas de estas aplicaciones incluyen:
- Electrofisiología: La electrofisiología es una rama de la medicina que utiliza técnicas electroquímicas para estudiar la actividad eléctrica en el cuerpo humano. Estas técnicas se utilizan para diagnosticar y tratar trastornos del ritmo cardíaco, como la fibrilación auricular.
- Biosensores: Los biosensores son dispositivos electroquímicos que utilizan reacciones bioquímicas para detectar y medir la presencia de sustancias específicas en muestras biológicas. Estos dispositivos son ampliamente utilizados en el campo de la medicina para el diagnóstico de enfermedades y el monitoreo de la salud.
Conclusiones
La electroquímica es una rama de la fisicoquímica que se centra en las leyes que rigen la generación de electricidad mediante reacciones químicas. Se basa en el estudio de las reacciones redox y se aplica en diversos campos como la energía, la industria, la tecnología y la medicina. Las celdas electroquímicas, como las celdas voltaicas y las baterías, son dispositivos fundamentales en la electroquímica para la generación y almacenamiento de energía eléctrica. La comprensión y control de las reacciones electroquímicas son fundamentales para abordar desafíos ambientales y energéticos, y se espera que la electroquímica desempeñe un papel cada vez más importante en el desarrollo de soluciones sostenibles y tecnológicas en el futuro.