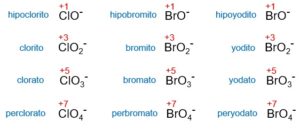
Exploraremos en detalle la formulación química de los oxoaniones. Los oxoaniones son iones negativos que se forman a partir de oxoácidos al perder hidrógeno. Estos iones están compuestos por un átomo central, generalmente un no metal, unido a uno o más átomos de oxígeno. A lo largo de este artículo, examinaremos ejemplos de oxoaniones, su estructura y las reglas que siguen.
¿Qué son los oxoaniones?
Los oxoaniones son iones negativos que se forman cuando un oxoácido pierde hidrógeno. Estos iones están compuestos por un átomo central, generalmente un no metal, unido a uno o más átomos de oxígeno. Los oxoaniones pueden tener diferentes cargas dependiendo de la cantidad de hidrógenos que pierdan.
Ejemplos de oxoaniones
Algunos ejemplos de oxoaniones son:
- Carbonato (CO32-)
- Borato (BO33-)
- Nitrito (NO2–)
- Nitrato (NO3–)
- Silicato (SiO44-)
- Fosfato (PO43-)
- Sulfato (SO42-)
- Clorato (ClO3–)
- Permanganato (MnO4–)
Regla del octeto en los oxoaniones
En general, los oxoaniones siguen la regla del octeto, lo que significa que tienden a tener ocho electrones de valencia. Esto se logra mediante la combinación de átomos de oxígeno con el átomo central y, en algunos casos, la adición de otros átomos. Sin embargo, existen excepciones a esta regla en algunos oxoaniones.
Estructura de los oxoaniones
La estructura de los oxoaniones puede variar dependiendo del número de átomos de oxígeno y la carga del ion. Algunos oxoaniones tienen una estructura de pirámide trigonal, como el ion nitrato (NO3–) y el ion carbonato (CO32-). Estos iones tienen un átomo central unido a tres átomos de oxígeno en una disposición triangular.
Por otro lado, algunos oxoaniones tienen una estructura lineal, como el ion sulfato (SO42-). En este caso, el átomo central está unido a cuatro átomos de oxígeno en una disposición lineal.
Además de las estructuras de pirámide trigonal y lineal, también existen oxoaniones con estructuras más complejas. Por ejemplo, el ion fosfato (PO43-) tiene una estructura tetraédrica, con el átomo central unido a cuatro átomos de oxígeno en una disposición tetraédrica.
Oxoaniones condensados
Los oxoaniones condensados se forman cuando un oxoanión con una carga alta experimenta una reacción de condensación. En esta reacción, los átomos de oxígeno se unen entre sí, formando enlaces adicionales y reduciendo la carga del ion. Un ejemplo de esto es la formación del ion dicromato (Cr2O72-), que se forma a partir del ion cromato (CrO42-) mediante una reacción de condensación.
Conclusión
Los oxoaniones son iones negativos que se forman a partir de oxoácidos al perder hidrógeno. Estos iones están compuestos por un átomo central unido a uno o más átomos de oxígeno. Los oxoaniones pueden tener diferentes cargas y su estructura puede variar dependiendo del número de átomos de oxígeno y la carga del ion. Aunque la mayoría de los oxoaniones siguen la regla del octeto, existen excepciones a esta regla. Además, algunos oxoaniones pueden experimentar reacciones de condensación, formando oxoaniones condensados con una carga reducida.