Exploraremos en detalle el concepto de orbital atómico. Veremos qué es un orbital atómico, cómo se define y cómo se relaciona con la estructura de los átomos. También examinaremos las diferentes formas y orientaciones de los orbitales atómicos y proporcionaremos ejemplos para una mejor comprensión.
¿Qué es un orbital atómico?
Un orbital atómico es una región alrededor del núcleo de un átomo donde hay una alta probabilidad de encontrar electrones. Cada electrón en un átomo ocupa un orbital atómico específico, que está definido por los números cuánticos.
Números cuánticos
Los números cuánticos son valores que describen las propiedades de los electrones en un átomo. Hay cuatro números cuánticos principales:
- Número cuántico principal (n)
- Número cuántico secundario o azimutal (l)
- Número cuántico magnético (m)
- Número cuántico de espín (s)
Estos números cuánticos determinan la forma, orientación y energía de los orbitales atómicos.
Formas y orientaciones de los orbitales atómicos
Los orbitales atómicos se pueden visualizar como capas o nubes alrededor del núcleo del átomo. Cada tipo de orbital tiene una forma y orientación específica. Los principales tipos de orbitales atómicos son:
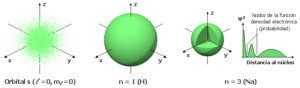
Orbitales s
Los orbitales s son esféricos y tienen una forma similar a una bola. Hay un tipo de orbital s en cada nivel de energía.
Orbitales p
Los orbitales p son en forma de lóbulos y tienen una forma similar a una figura de ocho. Hay tres tipos de orbitales p en cada nivel de energía.
Orbitales d
Los orbitales d tienen formas más complejas y pueden tener hasta cinco lóbulos. Hay cinco tipos de orbitales d en cada nivel de energía.
Orbitales f
Los orbitales f tienen formas aún más complejas y pueden tener hasta siete lóbulos. Hay siete tipos de orbitales f en cada nivel de energía.
Ejemplos de orbitales atómicos
Para comprender mejor los orbitales atómicos, aquí hay algunos ejemplos:
Ejemplo 1: Orbital 1s
El orbital 1s es el orbital más cercano al núcleo y tiene forma esférica. Solo puede contener un par de electrones.
Ejemplo 2: Orbitales 2p
Los orbitales 2p son tres en total y tienen forma de lóbulos. Cada orbital 2p puede contener un par de electrones.
Ejemplo 3: Orbitales 3d
Los orbitales 3d son cinco en total y tienen formas más complejas con hasta cinco lóbulos. Cada orbital 3d puede contener un par de electrones.
Conclusión
Los orbitales atómicos son regiones alrededor del núcleo de un átomo donde hay una alta probabilidad de encontrar electrones. Cada electrón ocupa un orbital atómico específico, que está definido por los números cuánticos. Los orbitales atómicos tienen diferentes formas y orientaciones, que se pueden visualizar como capas o nubes alrededor del núcleo. Comprender los orbitales atómicos es fundamental para comprender la estructura de los átomos y su comportamiento químico.