Exploraremos en detalle el concepto de los oxácidos, un tipo de compuesto químico que contiene oxígeno, hidrógeno y un elemento no metálico. Veremos su definición, cómo se forman, ejemplos comunes y sus aplicaciones industriales. También discutiremos las precauciones necesarias al manipular estos compuestos debido a su potencia corrosiva y oxidante.
Los oxácidos son compuestos químicos que se forman a partir de la combinación de oxígeno, hidrógeno y un elemento no metálico. Estos compuestos son de gran importancia en la industria y en la vida cotidiana debido a sus propiedades corrosivas y oxidantes. Exploraremos en detalle qué son los oxácidos, cómo se forman, ejemplos comunes y sus aplicaciones industriales. También discutiremos las precauciones necesarias al manipular estos compuestos debido a su potencia corrosiva y oxidante.
¿Qué es un oxácido?
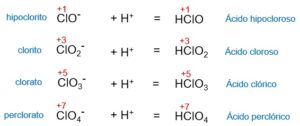
Un oxácido es un compuesto químico formado por oxígeno, hidrógeno y un elemento no metálico. Su fórmula general es HaXbOc, donde X representa un no metal o, en algunas ocasiones, un metal de transición. Estos compuestos se forman cuando un óxido ácido reacciona con agua.
Los oxácidos son compuestos químicos que contienen oxígeno, hidrógeno y un elemento no metálico. Estos compuestos se forman cuando un óxido ácido reacciona con agua. La fórmula general de un oxácido es HaXbOc, donde Ha representa átomos de hidrógeno, X representa un elemento no metálico y O representa átomos de oxígeno.
Composición de los oxácidos
Los oxácidos están compuestos por átomos de oxígeno, hidrógeno y un elemento no metálico. La cantidad de átomos de cada elemento en la fórmula del oxácido se indica mediante los subíndices a, b y c. Por ejemplo, en el ácido sulfúrico (H2SO4), hay 2 átomos de hidrógeno, 1 átomo de azufre y 4 átomos de oxígeno.
 Sales Ácidas
Sales ÁcidasLa composición de los oxácidos varía dependiendo del elemento no metálico presente en el compuesto. Sin embargo, en general, los oxácidos están compuestos por átomos de oxígeno, hidrógeno y un elemento no metálico. La cantidad de átomos de cada elemento se indica mediante subíndices en la fórmula del oxácido.
Formación de los oxácidos
Los oxácidos se forman cuando un óxido ácido reacciona con agua. Los óxidos ácidos son compuestos binarios que contienen oxígeno y un no metal. Al reaccionar con agua, estos óxidos se disocian y liberan iones hidrógeno (H+), que se combinan con los iones del no metal para formar el oxácido correspondiente.
La formación de los oxácidos ocurre a través de una reacción química entre un óxido ácido y agua. Los óxidos ácidos son compuestos binarios que contienen oxígeno y un no metal. Al reaccionar con agua, estos óxidos se disocian y liberan iones hidrógeno (H+), que se combinan con los iones del no metal para formar el oxácido correspondiente.
Reacción de los óxidos ácidos con agua
La reacción general de un óxido ácido con agua se puede representar de la siguiente manera:
Óxido ácido + Agua → Oxácido
 Ion
IonLa reacción de los óxidos ácidos con agua es una reacción química en la que el óxido ácido se combina con el agua para formar el oxácido correspondiente. Esta reacción es exotérmica, lo que significa que libera energía en forma de calor.
Ejemplos de oxácidos
Existen numerosos ejemplos de oxácidos, algunos de los cuales son ampliamente utilizados en la industria y en la vida cotidiana. A continuación, se presentan algunos ejemplos comunes:
Ácido sulfúrico (H2SO4)
El ácido sulfúrico es uno de los oxácidos más importantes y ampliamente utilizados. Se utiliza en la producción de fertilizantes, la elaboración de explosivos, la refinación de petróleo y la limpieza de materiales de laboratorio.
El ácido sulfúrico es uno de los oxácidos más importantes y ampliamente utilizados. Se utiliza en una amplia variedad de industrias, incluyendo la producción de fertilizantes, la elaboración de explosivos, la refinación de petróleo y la limpieza de materiales de laboratorio.
Ácido carbónico (H2CO3)
El ácido carbónico se encuentra en las bebidas carbonatadas y es responsable de su sabor ácido. También desempeña un papel importante en el equilibrio del pH en el cuerpo humano.
 Formulación
FormulaciónEl ácido carbónico se encuentra en las bebidas carbonatadas y es responsable de su sabor ácido. También desempeña un papel importante en el equilibrio del pH en el cuerpo humano.
Ácido crómico (H2CrO4)
El ácido crómico se utiliza en la industria de la galvanoplastia para recubrir metales con una capa de cromo. También se utiliza en la síntesis de compuestos orgánicos y en la fabricación de pigmentos.
El ácido crómico se utiliza en la industria de la galvanoplastia para recubrir metales con una capa de cromo. También se utiliza en la síntesis de compuestos orgánicos y en la fabricación de pigmentos.
Aplicaciones industriales de los oxácidos
Los oxácidos tienen diversas aplicaciones industriales debido a sus propiedades corrosivas y oxidantes. Algunas de estas aplicaciones incluyen:
Producción de fertilizantes
El ácido sulfúrico se utiliza en la producción de fertilizantes, ya que es necesario para la síntesis de compuestos como el fosfato de amonio y el sulfato de amonio, que son importantes nutrientes para las plantas.
El ácido sulfúrico se utiliza en la producción de fertilizantes, ya que es necesario para la síntesis de compuestos como el fosfato de amonio y el sulfato de amonio, que son importantes nutrientes para las plantas.
Elaboración de explosivos
El ácido sulfúrico también se utiliza en la elaboración de explosivos, ya que puede reaccionar con ciertos compuestos para liberar grandes cantidades de energía en forma de calor y gases.
El ácido sulfúrico también se utiliza en la elaboración de explosivos, ya que puede reaccionar con ciertos compuestos para liberar grandes cantidades de energía en forma de calor y gases.
Refinación de petróleo
En la industria petrolera, el ácido sulfúrico se utiliza en el proceso de refinación para eliminar impurezas y mejorar la calidad de los productos derivados del petróleo.
En la industria petrolera, el ácido sulfúrico se utiliza en el proceso de refinación para eliminar impurezas y mejorar la calidad de los productos derivados del petróleo.
Limpieza de materiales de laboratorio
El ácido sulfúrico se utiliza en la limpieza de materiales de laboratorio, ya que puede disolver residuos orgánicos y eliminar contaminantes.
El ácido sulfúrico se utiliza en la limpieza de materiales de laboratorio, ya que puede disolver residuos orgánicos y eliminar contaminantes.
Precauciones al manipular oxácidos
Debido a su potencia corrosiva y oxidante, los oxácidos deben ser manipulados con precaución. Algunas precauciones importantes incluyen:
Uso de equipo de protección personal
Al manipular oxácidos, es importante usar equipo de protección personal, como guantes, gafas de seguridad y batas de laboratorio, para evitar el contacto directo con la piel y los ojos.
Al manipular oxácidos, es importante usar equipo de protección personal, como guantes, gafas de seguridad y batas de laboratorio, para evitar el contacto directo con la piel y los ojos.
Manipulación en áreas bien ventiladas
Los oxácidos pueden liberar gases tóxicos o corrosivos, por lo que es importante manipularlos en áreas bien ventiladas para evitar la acumulación de vapores peligrosos.
Los oxácidos pueden liberar gases tóxicos o corrosivos, por lo que es importante manipularlos en áreas bien ventiladas para evitar la acumulación de vapores peligrosos.
Almacenamiento adecuado
Los oxácidos deben almacenarse en recipientes adecuados y etiquetados correctamente para evitar la contaminación y el riesgo de derrames.
Los oxácidos deben almacenarse en recipientes adecuados y etiquetados correctamente para evitar la contaminación y el riesgo de derrames.
Manipulación por personal capacitado
La manipulación de oxácidos debe ser realizada por personal capacitado y familiarizado con las precauciones necesarias para evitar accidentes y lesiones.
La manipulación de oxácidos debe ser realizada por personal capacitado y familiarizado con las precauciones necesarias para evitar accidentes y lesiones.
Conclusión
Los oxácidos son compuestos químicos formados por oxígeno, hidrógeno y un elemento no metálico. Se forman cuando un óxido ácido reacciona con agua y tienen diversas aplicaciones industriales. Sin embargo, debido a su potencia corrosiva y oxidante, es importante manipularlos con precaución y seguir las medidas de seguridad adecuadas.