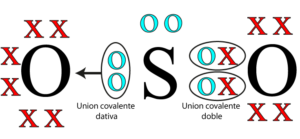
El enlace iónico es un tipo de enlace químico que se forma entre átomos de diferentes elementos cuando se produce una transferencia de electrones. Exploraremos las características y propiedades del enlace iónico, así como algunos ejemplos de compuestos iónicos.
¿Qué es el enlace iónico?
El enlace iónico se produce cuando los electrones se transfieren de un átomo a otro. Esto ocurre cuando un metal cede electrones y forma cationes estables, mientras que un no metal recibe esos electrones y forma aniones estables. La unión iónica se basa en la regla del octeto, que establece que los átomos tienden a completar su capa de valencia con ocho electrones para lograr estabilidad.
Características del enlace iónico
-
Fuerza considerable
Los enlaces iónicos son de una fuerza considerable, dependiendo de la naturaleza de los iones involucrados. La atracción electrostática entre los cationes y los aniones es lo que mantiene unidos a los compuestos iónicos.
Esta fuerza es lo que hace que los compuestos iónicos tengan puntos de fusión y ebullición altos, ya que se requiere una gran cantidad de energía para romper las fuerzas de atracción entre los iones.
-
Estructura cristalina
Los compuestos iónicos son sólidos a temperatura ambiente y tienen una estructura cristalina. Esto se debe a que los iones se organizan en una red tridimensional regular, formando una estructura ordenada y repetitiva.
Esta estructura cristalina es responsable de muchas de las propiedades físicas de los compuestos iónicos, como su dureza y su capacidad para formar cristales.
-
Altos puntos de fusión y ebullición
Los puntos de fusión y ebullición de los compuestos iónicos son altos, debido a la fuerte atracción electrostática entre los iones. Sin embargo, en algunos casos, si el enlace tiene un alto carácter covalente, los puntos de fusión y ebullición pueden disminuir.
Esta alta resistencia a los cambios de estado es una de las razones por las que los compuestos iónicos son sólidos a temperatura ambiente.
-
Formación entre metales y no metales
Los compuestos iónicos se forman entre metales de los grupos I y II y no metales de los grupos VI y VII. Esto se debe a que los metales tienden a ceder electrones y formar cationes positivos, mientras que los no metales tienden a recibir electrones y formar aniones negativos.
Esta transferencia de electrones es lo que crea la carga eléctrica en los iones y la atracción electrostática entre ellos.
-
Solubilidad en agua
Los compuestos iónicos son solubles en agua debido a la capacidad del agua para solvatar los iones y compensar la energía de red cristalina. Sin embargo, no todos los compuestos iónicos son solubles en agua debido a la baja energía de solvatación o al carácter covalente del enlace.
La solubilidad de los compuestos iónicos en agua depende de la polaridad de los iones y de la capacidad del agua para interactuar con ellos.
-
Conductividad eléctrica en solución acuosa
Los compuestos iónicos en solución acuosa se convierten en conductores de electricidad, ya que los iones se liberan y pueden moverse. Sin embargo, en estado sólido, los compuestos iónicos no son conductores de electricidad debido a la poca movilidad de los iones en la red.
Esta conductividad eléctrica en solución acuosa es una de las propiedades más importantes de los compuestos iónicos y se utiliza en muchas aplicaciones, como en las baterías y en la electroquímica.
Ejemplos de compuestos iónicos
Algunos ejemplos de compuestos iónicos incluyen:
- Cloruro de sodio (NaCl): El cloruro de sodio es un compuesto iónico formado por un catión de sodio (Na+) y un anión de cloruro (Cl-). Es conocido comúnmente como sal de mesa y se utiliza ampliamente como condimento.
- Sulfato de calcio (CaSO4): El sulfato de calcio es un compuesto iónico formado por un catión de calcio (Ca2+) y un anión de sulfato (SO4^2-). Es conocido como yeso y se utiliza en la construcción y en la industria del cemento.
- Nitrato de potasio (KNO3): El nitrato de potasio es un compuesto iónico formado por un catión de potasio (K+) y un anión de nitrato (NO3-). Es conocido como salitre y se utiliza en la fabricación de pólvora y fertilizantes.
- Óxido de magnesio (MgO): El óxido de magnesio es un compuesto iónico formado por un catión de magnesio (Mg2+) y un anión de oxígeno (O2-). Es conocido como magnesia y se utiliza en la fabricación de refractarios y en la industria farmacéutica.
- Fluoruro de litio (LiF): El fluoruro de litio es un compuesto iónico formado por un catión de litio (Li+) y un anión de fluoruro (F-). Se utiliza en la fabricación de vidrios especiales y en la industria nuclear.
Conclusión
El enlace iónico se produce cuando los electrones se transfieren de un átomo a otro, formando cationes y aniones estables. Los compuestos iónicos son sólidos, tienen una estructura cristalina y altos puntos de fusión y ebullición. Son solubles en agua y se convierten en conductores de electricidad en solución acuosa. En estado sólido, no son conductores de electricidad.