La electronegatividad es una propiedad química fundamental que describe la capacidad de un átomo para atraer electrones hacia sí mismo en un enlace químico. Exploraremos en detalle qué es la electronegatividad, cómo se aplica en la tabla periódica y su importancia en la formación de enlaces químicos.
¿Qué es la electronegatividad?
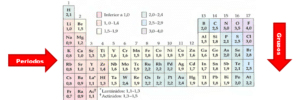
La electronegatividad es una medida de la capacidad de un átomo para atraer electrones hacia sí mismo cuando forma un enlace químico con otro átomo. Es una propiedad relativa que se expresa en una escala de valores, donde el flúor, con un valor de electronegatividad de 4.0, es el elemento más electronegativo. Cuanto mayor sea el valor de electronegatividad de un átomo, mayor será su capacidad para atraer electrones.
Aplicación de la electronegatividad en la tabla periódica
La electronegatividad se utiliza para determinar el tipo de enlace químico que se forma entre dos átomos. En la tabla periódica, la electronegatividad aumenta de izquierda a derecha en un periodo y de abajo hacia arriba en un grupo.
Enlace iónico
Un enlace iónico se forma cuando hay una gran diferencia de electronegatividad entre dos átomos. En este tipo de enlace, uno de los átomos atrae fuertemente los electrones de valencia del otro átomo, resultando en la transferencia completa de electrones y la formación de iones positivos y negativos. Los elementos con alta electronegatividad tienden a formar iones negativos (aniones), mientras que los elementos con baja electronegatividad tienden a formar iones positivos (cationes).
Enlace covalente polar
Un enlace covalente polar se forma cuando hay una diferencia moderada de electronegatividad entre dos átomos. En este tipo de enlace, los electrones de valencia se comparten de manera desigual, lo que resulta en una distribución asimétrica de la carga electrónica. El átomo más electronegativo atrae con mayor fuerza los electrones compartidos, adquiriendo una carga parcialmente negativa, mientras que el otro átomo adquiere una carga parcialmente positiva.
Enlace covalente no polar
Un enlace covalente no polar se forma cuando hay una diferencia mínima de electronegatividad entre dos átomos. En este tipo de enlace, los electrones de valencia se comparten de manera equitativa, resultando en una distribución simétrica de la carga electrónica. Ambos átomos tienen una atracción similar por los electrones compartidos y no adquieren cargas parciales.
La escala de electronegatividad de Pauling
La escala de electronegatividad más utilizada es la propuesta por Linus Pauling. En esta escala, el flúor tiene el valor más alto de electronegatividad, establecido en 4.0, y el cesio tiene el valor más bajo, establecido en 0.7. Los valores de electronegatividad de los demás elementos se determinan en relación con estos valores de referencia.
Factores que afectan la electronegatividad
La electronegatividad de un átomo puede variar debido a varios factores, como el tamaño del átomo, la carga nuclear efectiva y la distancia entre los núcleos de los átomos que forman el enlace químico. En general, los átomos más pequeños y con mayor carga nuclear efectiva tienden a tener una mayor electronegatividad.
Métodos para determinar la electronegatividad
Existen varios métodos para determinar la electronegatividad de un elemento. Uno de los métodos más comunes es el uso del promedio de la afinidad electrónica y la energía de ionización de los electrones de valencia del elemento. Otros métodos incluyen la comparación de las propiedades químicas de los compuestos formados por el elemento y la interpretación de la estructura electrónica del átomo.
Ejemplos de electronegatividad en la tabla periódica
A continuación, se presentan algunos ejemplos de cómo varía la electronegatividad en la tabla periódica:
- El flúor, con un valor de electronegatividad de 4.0, es el elemento más electronegativo.
- El cesio, con un valor de electronegatividad de 0.7, es el elemento menos electronegativo.
- El oxígeno, con un valor de electronegatividad de 3.5, es más electronegativo que el carbono, que tiene un valor de electronegatividad de 2.5.
- La electronegatividad aumenta de abajo hacia arriba dentro de un grupo. Por ejemplo, el flúor es más electronegativo que el cloro en el grupo de los halógenos.
- La electronegatividad aumenta de izquierda a derecha dentro de un periodo. Por ejemplo, el flúor es más electronegativo que el oxígeno en el tercer periodo de la tabla periódica.
Conclusión
La electronegatividad es una propiedad fundamental que describe la capacidad de un átomo para atraer electrones hacia sí mismo en un enlace químico. Su aplicación en la tabla periódica nos permite comprender cómo se forman los diferentes tipos de enlaces químicos. La electronegatividad varía dentro de la tabla periódica y puede determinarse a través de diferentes métodos. Comprender la electronegatividad nos ayuda a comprender mejor las propiedades y comportamientos de los elementos químicos.