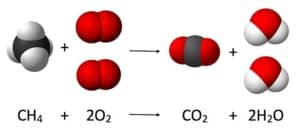
La estequiometría es una rama fundamental de la química que se encarga de estudiar las relaciones de masa en las reacciones químicas. Exploraremos los conceptos generales relacionados con la estequiometría, desde su definición hasta ejemplos prácticos.
La estequiometría es una herramienta esencial en la química, ya que nos permite comprender cómo los átomos se combinan y reorganizan para formar nuevas sustancias. A través de la estequiometría, podemos determinar las cantidades de reactivos necesarias para obtener una cantidad determinada de producto, así como también predecir la cantidad de producto que se formará a partir de una cantidad determinada de reactivo.
Definición de Estequiometría
La estequiometría es el vínculo numérico que se establece entre las masas de los elementos que componen una sustancia y la proporción en la que se combinan en una reacción química. Fue definida por Jeremias Benjamin Richter en el siglo XVIII como el estudio de las relaciones de masa en las reacciones químicas.
En otras palabras, la estequiometría nos permite determinar las cantidades relativas de los reactivos y productos en una reacción química, así como también las proporciones en las que se combinan. Esto es fundamental para comprender cómo ocurren las reacciones químicas y para poder predecir los resultados de dichas reacciones.
Ecuaciones Químicas
Las ecuaciones químicas son la representación escrita de una reacción química utilizando símbolos químicos para identificar los átomos y la forma en que se agrupan. En una ecuación química balanceada, se respeta la ley de conservación de la materia, que establece que la cantidad de átomos es igual en los reactivos y los productos.
Por ejemplo, la ecuación química para la reacción de formación del agua es:
2H2 + O2 → 2H2O
En esta ecuación, los números que preceden a los símbolos químicos (2 y 2) son los coeficientes estequiométricos, que indican la cantidad de moléculas de cada sustancia que participan en la reacción.
Balanceo de Ecuaciones Químicas
El balanceo de ecuaciones químicas es un proceso necesario para asegurar que se cumpla la ley de conservación de la materia. En este proceso, se ajustan los coeficientes estequiométricos de los reactivos y los productos para que la cantidad de átomos sea igual en ambos lados de la ecuación.
Por ejemplo, en la ecuación química anterior, podemos ver que hay 4 átomos de hidrógeno en los reactivos y solo 2 átomos de hidrógeno en los productos. Para balancear la ecuación, podemos agregar un coeficiente de 2 antes de la molécula de agua:
2H2 + O2 → 4H2O
Ahora, la ecuación está balanceada, ya que hay 4 átomos de hidrógeno en ambos lados de la ecuación.
Coeficiente Estequiométrico
El coeficiente estequiométrico en una ecuación química es la cantidad de moléculas de un cierto tipo que participan en la reacción. Estos coeficientes se utilizan para determinar las proporciones en las que los reactivos se combinan y los productos se forman en una reacción química.
Por ejemplo, en la ecuación química:
2H2 + O2 → 2H2O
El coeficiente estequiométrico de la molécula de hidrógeno (H2) es 2, lo que significa que se necesitan 2 moléculas de hidrógeno para reaccionar con 1 molécula de oxígeno (O2) y formar 2 moléculas de agua (H2O).
Unidades en Estequiometría
La unidad que relaciona las masas de los reactivos y los productos en un cálculo estequiométrico es el mol. Además del mol, existen otras unidades y conceptos importantes en la estequiometría, como la escala de la masa atómica, la masa atómica promedio, la masa molar, el peso molecular y el peso fórmula.
Mol
El mol es una unidad de medida utilizada en química para expresar la cantidad de sustancia. Un mol de cualquier sustancia contiene una cantidad fija de partículas, que es igual al número de Avogadro (6.022 x 10^23).
Por ejemplo, un mol de átomos de hidrógeno contiene 6.022 x 10^23 átomos de hidrógeno.
Escala de la Masa Atómica
La escala de la masa atómica es una escala relativa que se utiliza para comparar las masas de los átomos. El átomo de carbono-12 se utiliza como referencia y se le asigna una masa atómica de exactamente 12 unidades de masa atómica.
Por ejemplo, el átomo de hidrógeno tiene una masa atómica de aproximadamente 1 unidad de masa atómica, mientras que el átomo de oxígeno tiene una masa atómica de aproximadamente 16 unidades de masa atómica.
Masa Atómica Promedio
La masa atómica promedio es la masa promedio de los átomos de un elemento, teniendo en cuenta la abundancia de los diferentes isótopos de ese elemento. Se calcula multiplicando la masa de cada isótopo por su abundancia relativa y sumando los resultados.
Por ejemplo, la masa atómica promedio del carbono es de aproximadamente 12.01 unidades de masa atómica, ya que tiene dos isótopos principales: carbono-12 (con una abundancia del 98.9%) y carbono-13 (con una abundancia del 1.1%).
Masa Molar
La masa molar es la masa de un mol de una sustancia y se expresa en gramos por mol (g/mol). Se calcula sumando las masas atómicas de los átomos que componen la fórmula química de la sustancia.
Por ejemplo, la masa molar del agua (H2O) es de aproximadamente 18.02 g/mol, ya que contiene 2 átomos de hidrógeno (con una masa atómica de aproximadamente 1 g/mol cada uno) y 1 átomo de oxígeno (con una masa atómica de aproximadamente 16 g/mol).
Peso Molecular
El peso molecular es la masa de un mol de una sustancia y se expresa en unidades de masa atómica (u). Es igual a la suma de las masas atómicas de los átomos que componen la fórmula química de la sustancia.
Por ejemplo, el peso molecular del agua (H2O) es de aproximadamente 18.02 u, ya que contiene 2 átomos de hidrógeno (con una masa atómica de aproximadamente 1 u cada uno) y 1 átomo de oxígeno (con una masa atómica de aproximadamente 16 u).
Peso Fórmula
El peso fórmula es la masa de una fórmula unitaria de un compuesto iónico y se expresa en unidades de masa atómica (u). Es igual a la suma de las masas atómicas de los iones que componen la fórmula.
Por ejemplo, el peso fórmula del cloruro de sodio (NaCl) es de aproximadamente 58.44 u, ya que contiene un ion de sodio (con una masa atómica de aproximadamente 23 u) y un ion de cloruro (con una masa atómica de aproximadamente 35.5 u).
Cálculos Estequiométricos
Los cálculos estequiométricos se basan en los vínculos fijos de combinación que mantienen las sustancias en una reacción química balanceada. Estos cálculos permiten determinar las cantidades de reactivos necesarias para obtener una cantidad determinada de producto, o viceversa.
Relaciones de Masa en una Reacción Química
Las relaciones de masa en una reacción química se determinan utilizando los coeficientes estequiométricos de los reactivos y los productos. Estas relaciones permiten calcular las masas de los reactivos necesarias para obtener una cantidad determinada de producto, o viceversa.
Por ejemplo, en la reacción de formación del agua:
2H2 + O2 → 2H2O
Podemos determinar la masa de agua que se formará a partir de una masa determinada de hidrógeno o de oxígeno, utilizando las relaciones de masa establecidas por los coeficientes estequiométricos.
Ejemplos de Cálculos Estequiométricos
Los ejemplos de cálculos estequiométricos incluyen la determinación de la cantidad de reactivos necesarios para obtener una cantidad determinada de producto, la determinación de la cantidad de producto obtenida a partir de una cantidad determinada de reactivo, y la determinación de la cantidad de reactivo o producto en exceso en una reacción química.
Por ejemplo, si queremos determinar la cantidad de hidrógeno que se necesita para reaccionar completamente con 10 gramos de oxígeno en la reacción de formación del agua, podemos utilizar los coeficientes estequiométricos para establecer la relación de masa entre el hidrógeno y el oxígeno.
Conclusiones
La estequiometría es el estudio de las relaciones de masa en las reacciones químicas. Se basa en las ecuaciones químicas balanceadas y utiliza el coeficiente estequiométrico y el mol como unidades de medida. Además, se utilizan otros conceptos como la escala de la masa atómica, la masa molar y el peso molecular. Los cálculos estequiométricos permiten determinar las cantidades de reactivos necesarias para obtener una cantidad determinada de producto, o viceversa.