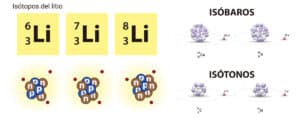
En química, los isóbaros son átomos que tienen el mismo número de masa, pero un número atómico diferente. Esto significa que son átomos de diferentes elementos químicos con propiedades químicas distintas. Los isóbaros se caracterizan por tener la misma cantidad neta de protones y neutrones en el núcleo, pero la cantidad de protones y neutrones individuales es diferente. Exploraremos en detalle qué son los isóbaros, cómo se diferencian de otros conceptos relacionados y proporcionaremos ejemplos para una mejor comprensión.
Contenido
-
Definición de isóbaros
Los isóbaros son átomos que tienen el mismo número de masa, pero un número atómico diferente. Esto significa que tienen la misma cantidad neta de protones y neutrones en el núcleo, pero la cantidad de protones y neutrones individuales es diferente. Los isóbaros se representan utilizando el símbolo químico del elemento seguido del número de masa entre paréntesis. Por ejemplo, el isóbaro del carbono-14 se representa como C-14 y el isóbaro del nitrógeno-14 se representa como N-14.
Los isóbaros tienen propiedades químicas diferentes debido a su diferente número atómico. Aunque tienen la misma cantidad de nucleones en el núcleo, la cantidad de protones y neutrones individuales es diferente, lo que afecta las interacciones químicas y las propiedades físicas de los isóbaros.
-
Diferencia entre isóbaros, isótopos e isótonos
Los isóbaros se diferencian de los isótopos y los isótonos. Los isótopos son átomos del mismo elemento químico que tienen el mismo número atómico pero diferente número de masa. Esto significa que tienen la misma cantidad de protones en el núcleo, pero diferente cantidad de neutrones. Los isótopos tienen propiedades químicas similares debido a su mismo número atómico, pero pueden tener propiedades físicas diferentes debido a su diferente número de masa.
Por otro lado, los isótonos son átomos que tienen diferente número atómico y diferente número de masa. Esto significa que tienen diferente cantidad de protones y neutrones en el núcleo. Los isótonos tienen propiedades químicas y físicas diferentes debido a su diferente número atómico y número de masa.
Los isóbaros tienen el mismo número de masa pero diferente número atómico, los isótopos tienen el mismo número atómico pero diferente número de masa, y los isótonos tienen diferente número atómico y diferente número de masa.
-
Ejemplos de isóbaros
Algunos ejemplos de isóbaros incluyen el carbono-14 y el nitrógeno-14. Ambos tienen el mismo número de masa, que es 14, pero tienen un número atómico diferente. El carbono-14 tiene 6 protones en el núcleo y 8 neutrones, mientras que el nitrógeno-14 tiene 7 protones y 7 neutrones.
Otro ejemplo de isóbaros es el oxígeno-16 y el azufre-16. Ambos tienen un número de masa de 16, pero tienen un número atómico diferente. El oxígeno-16 tiene 8 protones y 8 neutrones, mientras que el azufre-16 tiene 16 protones y 16 neutrones.
Estos ejemplos ilustran cómo los isóbaros pueden ser átomos de diferentes elementos químicos con propiedades químicas distintas, pero con la misma cantidad neta de protones y neutrones en el núcleo.
-
Aplicaciones de los isóbaros
Los isóbaros tienen varias aplicaciones en la química y la física. Una de las aplicaciones más conocidas es en la datación por radiocarbono. El carbono-14, que es un isóbaro del carbono-12, se utiliza para determinar la edad de materiales orgánicos antiguos. La proporción de carbono-14 a carbono-12 en un material puede indicar cuánto tiempo ha pasado desde que el organismo murió.
Los isóbaros también se utilizan en la identificación de elementos en espectrometría de masas. La espectrometría de masas es una técnica analítica que se utiliza para determinar la composición y estructura de una muestra. Al comparar las masas de los iones formados por diferentes isóbaros, es posible identificar los elementos presentes en la muestra.
Otra aplicación de los isóbaros es en la investigación de reacciones nucleares. Al estudiar las reacciones nucleares que involucran isóbaros, los científicos pueden obtener información sobre la estructura y las propiedades de los núcleos atómicos.
-
Los isóbaros son átomos de diferentes elementos químicos que tienen el mismo número de masa pero un número atómico diferente. Son importantes en la química y la física debido a sus aplicaciones en diversas áreas de estudio. Los isóbaros se diferencian de los isótopos y los isótonos, que tienen diferentes combinaciones de número atómico y número de masa. Los ejemplos de isóbaros incluyen el carbono-14 y el nitrógeno-14, así como el oxígeno-16 y el azufre-16. Los isóbaros tienen aplicaciones en la datación por radiocarbono, la identificación de elementos en espectrometría de masas y la investigación de reacciones nucleares.