Ley Periódica
La ley periódica es la base de la tabla periódica de los elementos. Esta ley señala que las propiedades químicas y físicas de los elementos tienden a repetirse de manera sistemática a medida que se incrementa el número atómico.
La tabla periódica es un esquema que ordena los elementos químicos de acuerdo al orden creciente de los números atómicos. Fue propuesta por John Alexander Reina Newlands en 1863 y posteriormente desarrollada por Julius Lothar Meyer y Dmitri Mendeleiev. La tabla periódica se compone de columnas verticales llamadas grupos, que incluyen elementos con propiedades similares, y filas horizontales llamadas periodos, que agrupan elementos con propiedades diferentes pero masas similares.
Origen y Desarrollo de la Ley Periódica
La tabla periódica fue propuesta por John Alexander Reina Newlands en 1863 y posteriormente desarrollada por Julius Lothar Meyer y Dmitri Mendeleiev. Estos científicos observaron que al ordenar los elementos de acuerdo al orden creciente de los números atómicos, se podían identificar patrones en las propiedades de los elementos.
John Alexander Reina Newlands
John Alexander Reina Newlands fue el primero en proponer una clasificación periódica de los elementos. En su ley periódica, organizó los elementos en orden creciente de sus masas atómicas y notó que las propiedades químicas se repetían cada ocho elementos, lo que llamó "ley de las octavas". Sin embargo, su clasificación fue criticada y no fue ampliamente aceptada en su época.
Julius Lothar Meyer
Julius Lothar Meyer también propuso una clasificación periódica de los elementos, basada en el volumen atómico. Observó que las propiedades químicas de los elementos se repetían periódicamente cuando se ordenaban de acuerdo a su volumen atómico.
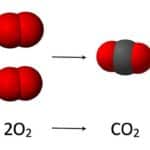 Estequiometría
EstequiometríaDmitri Mendeleiev
Dmitri Mendeleiev es considerado el padre de la tabla periódica moderna. En 1869, presentó una versión mejorada de la tabla periódica, en la que organizó los elementos de acuerdo a su masa atómica y sus propiedades químicas. Mendeleiev dejó espacios vacíos en su tabla para elementos que aún no se habían descubierto, y predijo las propiedades de estos elementos desconocidos.
Confirmación de la Ley Periódica
La ley periódica fue confirmada por Henry Moseley en 1913. Moseley estableció una relación sistemática entre el número atómico y la longitud de onda de los rayos X emitidos por los átomos. Esta relación, conocida como la ley de Moseley, demostró que el número atómico es la propiedad fundamental que determina las propiedades químicas de los elementos.
La Tabla Periódica
La tabla periódica es un esquema que ordena los elementos químicos de acuerdo al orden creciente de los números atómicos. Está compuesta por columnas verticales llamadas grupos y filas horizontales llamadas periodos.
Grupos
Los grupos son columnas verticales en la tabla periódica. Cada grupo incluye elementos con propiedades químicas y físicas similares. Por ejemplo, el grupo 1, conocido como los metales alcalinos, incluye elementos como el litio, el sodio y el potasio, que son altamente reactivos y tienden a formar iones positivos.
Periodos
Los periodos son filas horizontales en la tabla periódica. Cada periodo agrupa elementos con propiedades diferentes pero masas similares. Por ejemplo, el periodo 2 incluye elementos como el litio, el berilio, el boro y el carbono, que tienen diferentes propiedades químicas pero masas atómicas similares.
 Espuma
EspumaImportancia de la Tabla Periódica
La tabla periódica es una herramienta fundamental en la química. Permite organizar y comprender las propiedades de los elementos, así como predecir las propiedades de elementos desconocidos. Además, la tabla periódica es utilizada en la enseñanza de la química y en la investigación científica.
Ejemplos de Aplicación de la Ley Periódica
La ley periódica tiene numerosas aplicaciones en la química y otras disciplinas científicas. Algunos ejemplos de su aplicación incluyen:
1. Predicción de Propiedades de los Elementos
La tabla periódica permite predecir las propiedades de elementos desconocidos. Por ejemplo, Mendeleiev predijo las propiedades del galio y el germanio antes de que fueran descubiertos.
2. Identificación de Elementos Desconocidos
La tabla periódica es utilizada para identificar elementos desconocidos. Al comparar las propiedades de un elemento desconocido con las propiedades de los elementos conocidos, es posible determinar su identidad.
3. Relaciones entre Elementos y Compuestos
La tabla periódica permite identificar relaciones entre elementos y compuestos. Por ejemplo, los elementos de un mismo grupo tienden a formar compuestos con propiedades similares.
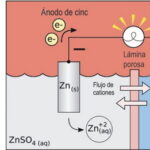 Electroquímica
Electroquímica4. Determinación de Configuraciones Electrónicas
La tabla periódica es utilizada para determinar las configuraciones electrónicas de los elementos. La configuración electrónica de un elemento está relacionada con sus propiedades químicas y su reactividad.
Conclusión
La ley periódica es la base de la tabla periódica de los elementos. Esta ley señala que las propiedades químicas y físicas de los elementos tienden a repetirse de manera sistemática a medida que se incrementa el número atómico. La tabla periódica es una herramienta fundamental en la química y permite organizar y comprender las propiedades de los elementos.
También te puede interesar: