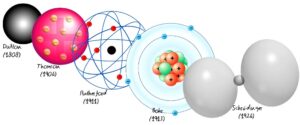
El modelo atómico es una representación teórica de la estructura y comportamiento de los átomos, las unidades fundamentales de la materia. A lo largo de la historia, este modelo ha evolucionado a medida que se han realizado nuevos descubrimientos y se ha avanzado en el conocimiento científico. Exploraremos la evolución del modelo atómico, desde las primeras teorías propuestas hasta el modelo actual basado en la teoría cuántica.
El estudio de los átomos y su estructura ha sido fundamental para comprender la naturaleza de la materia y las propiedades químicas de los elementos. A lo largo de los siglos, los científicos han propuesto diferentes modelos atómicos para explicar cómo están compuestos los átomos y cómo interactúan entre sí.
Modelo Atómico de Dalton
El modelo atómico de Dalton, propuesto por John Dalton en el siglo XIX, postulaba que los átomos eran partículas indivisibles e indestructibles que formaban la materia. Dalton también planteó que los átomos de diferentes elementos tenían diferentes masas y propiedades.
Según Dalton, los átomos se combinaban entre sí en proporciones fijas para formar compuestos químicos. Esta idea se conoce como la ley de las proporciones definidas. Dalton también propuso que los átomos no se crean ni se destruyen durante una reacción química, sino que simplemente se reorganizan.
Aunque el modelo atómico de Dalton fue una contribución importante para la comprensión de la materia, se descubrió más tarde que los átomos no eran indivisibles y que estaban compuestos por partículas subatómicas.
Modelo Atómico de Thomson
El modelo atómico de Thomson, propuesto por J.J. Thomson en 1897, sugirió que los átomos eran esferas cargadas positivamente con electrones incrustados en ellas, similar a un «pudín de pasas». Thomson descubrió el electrón y demostró que tenía carga negativa.
Thomson realizó experimentos con tubos de rayos catódicos, que son tubos de vidrio en los que se hace pasar una corriente eléctrica a través de un gas a baja presión. Observó que los rayos catódicos estaban compuestos por partículas cargadas negativamente, a las que llamó electrones.
Basándose en sus experimentos, Thomson propuso que los electrones estaban incrustados en una esfera cargada positivamente, lo que le dio al átomo una carga eléctrica neutra en general. Este modelo fue conocido como el modelo del «pudín de pasas» o el modelo de Thomson.
Aunque el modelo de Thomson fue un avance significativo en la comprensión de la estructura del átomo, se descubrió más tarde que los electrones no estaban distribuidos uniformemente en el átomo, sino que estaban confinados en órbitas alrededor de un núcleo central.
Modelo Atómico de Rutherford
El modelo atómico de Rutherford, propuesto por Ernest Rutherford en 1911, se basó en el experimento de la lámina de oro. Rutherford descubrió que la mayor parte de la masa y la carga positiva de un átomo se concentraba en un núcleo pequeño y denso en el centro, mientras que los electrones giraban alrededor del núcleo en órbitas.
En su experimento, Rutherford bombardeó una lámina de oro con partículas alfa, que son partículas cargadas positivamente. Esperaba que las partículas alfa pasaran a través de la lámina sin desviarse significativamente, ya que según el modelo de Thomson, los átomos eran esferas cargadas positivamente.
Sin embargo, Rutherford observó que algunas partículas alfa se desviaban en ángulos inesperados y otras incluso rebotaban hacia atrás. Esto llevó a la conclusión de que la mayor parte de la masa y la carga positiva del átomo estaban concentradas en un núcleo pequeño y denso en el centro.
El modelo atómico de Rutherford fue un avance importante en la comprensión de la estructura del átomo, pero tenía una limitación: no explicaba cómo los electrones se mantenían en órbita alrededor del núcleo sin caer hacia él debido a la atracción electrostática.
Modelo Atómico de Bohr
El modelo atómico de Bohr, propuesto por Niels Bohr en 1913, incorporó la idea de niveles de energía cuantizados en los que los electrones podían orbitar alrededor del núcleo. Bohr postuló que los electrones se encontraban en órbitas estables y que solo podían cambiar de nivel de energía emitiendo o absorbiendo energía en forma de fotones.
Bohr utilizó la teoría cuántica de Max Planck y la teoría del efecto fotoeléctrico de Albert Einstein para desarrollar su modelo. Según Bohr, los electrones se encuentran en niveles de energía discretos alrededor del núcleo y solo pueden ocupar ciertos niveles permitidos.
El modelo de Bohr explicaba la estabilidad de los átomos y la emisión y absorción de energía en forma de fotones. Sin embargo, tenía limitaciones, ya que no podía explicar completamente el comportamiento de los átomos más complejos y no tenía en cuenta los efectos de la mecánica cuántica.
Modelo Atómico Cuántico
El modelo atómico cuántico, desarrollado a partir de la década de 1920, se basa en la teoría cuántica y la ecuación de Schrödinger. Propone que los electrones no se mueven en órbitas definidas, sino que se encuentran en regiones de alta probabilidad de encontrarlos, conocidas como orbitales. Los orbitales se describen mediante funciones de onda y números cuánticos.
El modelo atómico cuántico permite predecir con precisión las propiedades de los átomos y las moléculas, y ha sido fundamental para el desarrollo de la química cuántica y la física de partículas. También ha llevado al descubrimiento de partículas subatómicas, como los quarks y los leptones.
El modelo atómico cuántico ha sido validado por numerosos experimentos y observaciones, y es el modelo actualmente aceptado para describir la estructura y el comportamiento de los átomos.
Modelo Atómico Actual
El modelo atómico actual se basa en la teoría cuántica y en los avances en la tecnología de observación y experimentación. Se ha demostrado que los átomos están compuestos por un núcleo central que contiene protones y neutrones, rodeado por electrones que se encuentran en orbitales alrededor del núcleo.
Los protones tienen carga positiva y los electrones tienen carga negativa, lo que mantiene al átomo eléctricamente neutro. Los neutrones no tienen carga eléctrica y su función principal es estabilizar el núcleo.
Además de los protones, neutrones y electrones, se ha descubierto la existencia de partículas subatómicas más pequeñas, como los quarks y los leptones. Estas partículas son los constituyentes fundamentales de los protones y neutrones, y juegan un papel importante en la comprensión de la estructura del núcleo atómico.
El modelo atómico actual también tiene en cuenta la dualidad onda-partícula de los electrones y otras partículas subatómicas. Según la teoría cuántica, las partículas subatómicas pueden comportarse tanto como partículas puntuales como ondas de probabilidad.
El modelo atómico ha evolucionado desde la idea de átomos indivisibles hasta la comprensión actual de la estructura cuántica del átomo. Cada modelo ha contribuido al avance del conocimiento científico y ha permitido una mejor comprensión de la materia y sus propiedades.
Conclusiones
El modelo atómico ha evolucionado desde la idea de átomos indivisibles hasta la comprensión actual de la estructura cuántica del átomo. Cada modelo ha contribuido al avance del conocimiento científico y ha permitido una mejor comprensión de la materia y sus propiedades.