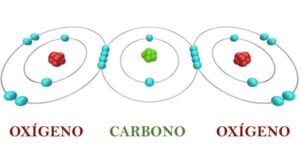
La regla del octeto es una teoría en química propuesta por el fisicoquímico Gilbert N. Lewis en 1916. Esta regla establece que los átomos tienden a completar su capa de valencia con ocho electrones para alcanzar una configuración electrónica estable, similar a la de los gases nobles.
Según la regla del octeto, los átomos pueden ganar, perder o compartir electrones con otros átomos para lograr esta configuración estable. Los átomos que ganan electrones se convierten en iones negativos (aniones), mientras que los átomos que pierden electrones se convierten en iones positivos (cationes).
¿Cómo funciona la regla del octeto?
La regla del octeto se aplica principalmente a los elementos de la tabla periódica, especialmente a los elementos no metales. Estos elementos tienden a ganar electrones para alcanzar una configuración de ocho electrones en su capa de valencia, lo que les permite adquirir una carga negativa y formar iones negativos.
Ejemplo de aplicación de la regla del octeto
Por ejemplo, el cloro, que tiene siete electrones en su capa de valencia, tiende a ganar un electrón para completar su octeto y convertirse en un ion cloruro (Cl-). De manera similar, el oxígeno, que tiene seis electrones en su capa de valencia, tiende a ganar dos electrones para completar su octeto y convertirse en un ion óxido (O2-).
Excepciones a la regla del octeto
En el caso de los elementos metálicos, la regla del octeto no siempre se cumple estrictamente. Los metales tienden a perder electrones para formar cationes positivos y alcanzar una configuración electrónica estable. Sin embargo, algunos metales pueden formar compuestos en los que comparten electrones con otros átomos, en lugar de perderlos por completo.
Ejemplos de excepciones a la regla del octeto
Algunos elementos, como el hidrógeno y el helio, solo necesitan dos electrones para alcanzar una configuración estable. Además, algunos elementos pueden tener más de ocho electrones en su capa de valencia, como los elementos del tercer periodo y más allá, que pueden acomodar hasta 12 o incluso 18 electrones en su capa de valencia.
Aplicaciones de la regla del octeto
La regla del octeto es especialmente importante en la formación de enlaces químicos. Los átomos pueden formar enlaces iónicos o covalentes para alcanzar una configuración de ocho electrones en su capa de valencia. En los enlaces iónicos, los átomos transfieren electrones para formar iones con cargas opuestas que se atraen entre sí. En los enlaces covalentes, los átomos comparten electrones para completar su octeto.
Ejemplo de aplicación de la regla del octeto en enlaces químicos
Por ejemplo, en el enlace entre el sodio (Na) y el cloro (Cl), el sodio pierde un electrón y el cloro gana ese electrón, formando un enlace iónico y creando el compuesto cloruro de sodio (NaCl). En este compuesto, el sodio tiene una carga positiva y el cloro tiene una carga negativa, cumpliendo así con la regla del octeto.
La regla del octeto en moléculas
La regla del octeto también se aplica a las moléculas, donde los átomos se unen mediante enlaces químicos para formar estructuras estables. En las moléculas, los átomos tienden a compartir electrones de manera que cada átomo tenga ocho electrones en su capa de valencia.
Ejemplo de aplicación de la regla del octeto en moléculas
Por ejemplo, en la molécula de agua (H2O), el oxígeno comparte electrones con dos átomos de hidrógeno, formando enlaces covalentes y cumpliendo con la regla del octeto. En esta molécula, el oxígeno tiene dos pares de electrones no compartidos y dos pares de electrones compartidos, lo que le da una configuración de ocho electrones en su capa de valencia.
Conclusión
La regla del octeto es una teoría en química que establece que los átomos tienden a completar su capa de valencia con ocho electrones para alcanzar una configuración electrónica estable. Esta regla se aplica principalmente a los elementos no metales y es importante en la formación de enlaces químicos y moléculas. Sin embargo, existen excepciones a esta regla, especialmente para elementos como el hidrógeno y los elementos del tercer periodo en adelante.