El radio atómico es una propiedad fundamental de los átomos que determina su tamaño. Es la mitad de la distancia entre los núcleos de dos átomos adyacentes unidos por un enlace covalente, o la distancia entre el orbital más externo de un átomo y su núcleo. El radio atómico es una medida importante para comprender las propiedades físicas y químicas de los elementos.
Exploraremos en detalle el concepto del radio atómico, los factores que afectan su valor y cómo varía en la tabla periódica. También proporcionaremos algunos ejemplos para ilustrar su aplicación en la química.
Concepto del Radio Atómico
El radio atómico se define como la distancia entre el núcleo de un átomo y su orbital más externo. Es una medida del tamaño de un átomo y puede variar dependiendo del elemento y su posición en la tabla periódica.
Radio Atómico Covalente
El radio atómico covalente se refiere a la mitad de la distancia entre los núcleos de dos átomos adyacentes unidos por un enlace covalente. En un enlace covalente, los átomos comparten electrones para formar una molécula. El radio atómico covalente se utiliza para determinar el tamaño de los átomos en una molécula.
Radio Atómico Metálico
El radio atómico metálico se refiere a la mitad de la distancia entre los núcleos de dos átomos adyacentes en un sólido metálico. En los metales, los átomos están dispuestos en una estructura cristalina y forman una red tridimensional. El radio atómico metálico se utiliza para determinar el tamaño de los átomos en un sólido metálico.
Factores que afectan el Radio Atómico
El radio atómico puede variar debido a varios factores, incluyendo:
- Carga nuclear efectiva: A medida que aumenta la carga nuclear efectiva, los electrones se atraen más hacia el núcleo, lo que disminuye el radio atómico.
- Número de capas electrónicas: A medida que aumenta el número de capas electrónicas, el radio atómico aumenta.
- Carga nuclear: A medida que aumenta la carga nuclear, los electrones se atraen más hacia el núcleo, lo que disminuye el radio atómico.
- Repulsión electrónica: A medida que aumenta la repulsión electrónica entre los electrones en la misma capa, el radio atómico aumenta.
Estos factores interactúan entre sí y determinan el tamaño de un átomo en un estado dado.
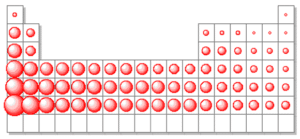
Variación del Radio Atómico en la Tabla Periódica
El radio atómico tiende a aumentar hacia abajo y hacia la izquierda en la tabla periódica. Esto se debe a la adición de capas electrónicas y al aumento de la distancia entre el núcleo y los electrones más externos.
Variación del Radio Atómico en un Grupo
En un grupo de la tabla periódica, el radio atómico tiende a aumentar hacia abajo. Esto se debe a la adición de capas electrónicas a medida que se desciende en el grupo.
Por ejemplo, en el grupo 1 de la tabla periódica, el radio atómico aumenta a medida que se desciende desde el hidrógeno hasta el francio. Esto se debe a que cada elemento en el grupo 1 tiene una capa electrónica adicional en comparación con el anterior, lo que resulta en un aumento en el tamaño del átomo.
Variación del Radio Atómico en un Período
En un período de la tabla periódica, el radio atómico tiende a disminuir de izquierda a derecha. Esto se debe a la mayor carga nuclear efectiva y a la disminución de la distancia entre el núcleo y los electrones más externos.
Por ejemplo, en el período 3 de la tabla periódica, el radio atómico disminuye a medida que se avanza desde el sodio hasta el cloro. Esto se debe a que, a medida que se avanza hacia la derecha en el período, los átomos tienen más protones en su núcleo, lo que aumenta la carga nuclear efectiva y atrae más fuertemente a los electrones hacia el núcleo, disminuyendo así el tamaño del átomo.
Ejemplos de Radio Atómico
A continuación se presentan algunos ejemplos de radio atómico:
- El radio atómico del hidrógeno es de aproximadamente 53 picómetros (pm).
- El radio atómico del oxígeno es de aproximadamente 66 pm.
- El radio atómico del sodio es de aproximadamente 186 pm.
- El radio atómico del potasio es de aproximadamente 227 pm.
Estos ejemplos ilustran cómo el radio atómico puede variar entre diferentes elementos y cómo se puede utilizar para comparar el tamaño de los átomos.
Conclusiones
El radio atómico es una propiedad fundamental de los átomos que determina su tamaño. Puede variar dependiendo del elemento y su posición en la tabla periódica. El radio atómico covalente se refiere a la distancia entre los núcleos de dos átomos adyacentes en un enlace covalente, mientras que el radio atómico metálico se refiere a la distancia entre los núcleos de dos átomos adyacentes en un sólido metálico. El radio atómico tiende a aumentar hacia abajo y hacia la izquierda en la tabla periódica.