Las reacciones redox son procesos químicos en los que se produce un intercambio de electrones entre los átomos o moléculas involucrados. Estas reacciones son fundamentales en la química y tienen una amplia variedad de aplicaciones en la vida diaria y en la industria. Exploraremos en detalle las características de las reacciones redox y proporcionaremos ejemplos para una mejor comprensión.
¿Qué son las reacciones redox?
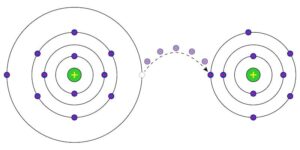
Las reacciones redox, también conocidas como reacciones de oxidación-reducción, son procesos químicos en los que ocurre un intercambio de electrones entre los reactivos. En estas reacciones, hay dos tipos de reactivos principales:
- Agente oxidante: Es el reactivo que capta electrones y se reduce en el proceso.
- Agente reductor: Es el reactivo que cede electrones y se oxida en el proceso.
El agente oxidante y el agente reductor están involucrados en una relación de transferencia de electrones, donde el agente oxidante acepta los electrones cedidos por el agente reductor.
Características de las reacciones redox
Las reacciones redox presentan varias características distintivas que las diferencian de otros tipos de reacciones químicas. Estas características incluyen:
- Intercambio de electrones: En las reacciones redox, se produce un intercambio de electrones entre los reactivos. El agente oxidante acepta electrones del agente reductor, lo que resulta en una transferencia de carga eléctrica.
- Cambio en el estado de oxidación: El estado de oxidación de los átomos o iones involucrados en una reacción redox cambia durante el proceso. El agente oxidante experimenta una reducción, lo que implica una disminución en su estado de oxidación, mientras que el agente reductor experimenta una oxidación, lo que implica un aumento en su estado de oxidación.
- Conservación de la carga: En una reacción redox, la carga total se conserva. Esto significa que la cantidad total de electrones cedidos por el agente reductor es igual a la cantidad total de electrones aceptados por el agente oxidante.
- Equilibrio redox: Las reacciones redox pueden alcanzar un estado de equilibrio, donde la velocidad de la reacción directa (oxidación) es igual a la velocidad de la reacción inversa (reducción). En este estado, la concentración de los reactivos y productos se mantiene constante.
Tipos de reacciones redox
Existen varios tipos de reacciones redox, cada uno con características y aplicaciones específicas. Algunos de los tipos más comunes son:
Combustión
La combustión es un tipo de reacción redox en la que un compuesto orgánico o un hidrocarburo reacciona con oxígeno para producir dióxido de carbono y agua. Esta reacción libera una gran cantidad de energía en forma de calor y luz. Un ejemplo común de combustión es la quema de combustibles fósiles en motores de automóviles y plantas de energía.
Oxidación de metales
La oxidación de metales es un tipo de reacción redox en la que los metales reaccionan con el oxígeno del aire o con otros compuestos para formar óxidos metálicos. Esta reacción puede resultar en la corrosión y degradación de los metales. Un ejemplo común de oxidación de metales es la formación de óxido de hierro (óxido de hierro) en la superficie del hierro expuesto al aire y la humedad.
Desproporción
La desproporción es un tipo de reacción redox en la que un reactivo se reduce y se oxida al mismo tiempo. Esto significa que una molécula o ion se divide en dos productos diferentes, uno con un estado de oxidación más bajo y otro con un estado de oxidación más alto. Un ejemplo común de desproporción es la descomposición del peróxido de hidrógeno (agua oxigenada) en agua y oxígeno.
Desplazamiento simple
El desplazamiento simple es un tipo de reacción redox en la que un elemento reemplaza a otro en un compuesto. Esto ocurre cuando un elemento más reactivo desplaza a otro elemento menos reactivo en un compuesto. Un ejemplo común de desplazamiento simple es la reacción entre el zinc metálico y el ácido clorhídrico para producir cloruro de zinc y liberar hidrógeno gaseoso.
Aplicaciones de las reacciones redox
Las reacciones redox tienen una amplia variedad de aplicaciones en la vida diaria y en la industria. Algunas de las aplicaciones más comunes incluyen:
- Generación de electricidad en plantas eléctricas y pilas.
- Funcionamiento de motores de vehículos y maquinaria.
- Producción de sales y otros compuestos químicos.
- Obtención de elementos en un estado de pureza.
- Tratamiento de aguas residuales y purificación de agua potable.
- Producción de energía en celdas de combustible.
Conclusión
Las reacciones redox son procesos químicos en los que se produce un intercambio de electrones entre los reactivos. Estas reacciones se caracterizan por la presencia de un agente oxidante y un agente reductor, y pueden ser de diferentes tipos, como la combustión, la oxidación de metales, la desproporción y el desplazamiento simple. Estas reacciones son comunes en la vida diaria y tienen diversas aplicaciones industriales. Comprender las características y los tipos de reacciones redox es fundamental para comprender la química y su impacto en nuestro entorno.