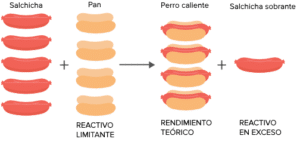
En una reacción química, el reactivo limitante juega un papel crucial en determinar la cantidad máxima de producto que se puede obtener. Exploraremos la importancia del reactivo limitante, su definición y concepto, y proporcionaremos ejemplos para una mejor comprensión.
¿Qué es el reactivo limitante?
El reactivo limitante, también conocido como reactivo limitado o reactivo limitado, es la sustancia que se consume por completo en una reacción química. Es el reactivo que determina la cantidad máxima de producto que se puede obtener.
¿Cómo se determina el reactivo limitante?
Para determinar el reactivo limitante en una reacción química, se deben comparar las cantidades de los reactivos presentes en relación a las proporciones estequiométricas de la ecuación química balanceada. El reactivo que se encuentra en menor cantidad en relación a su coeficiente estequiométrico es el reactivo limitante.
¿Qué sucede con el reactivo limitante?
Cuando el reactivo limitante se consume por completo, la reacción se detiene y ya no se puede formar más producto. Los otros reactivos que aún quedan sin reaccionar se denominan reactivos en exceso.
Importancia del reactivo limitante
El reactivo limitante es de suma importancia en una reacción química por las siguientes razones:
Determina la cantidad máxima de producto
La cantidad de producto que se forma en una reacción química está determinada por la cantidad de reactivo limitante presente. Si se agota el reactivo limitante, la reacción se detiene y no se puede formar más producto. Por lo tanto, el reactivo limitante limita la cantidad de producto que se puede obtener.
Cálculos estequiométricos
Al realizar cálculos estequiométricos, que son los cálculos de las relaciones cuantitativas entre los reactivos y productos en una reacción química, es importante tener en cuenta el reactivo limitante. Conociendo la cantidad de reactivo limitante, es posible determinar la cantidad de producto que se puede obtener.
Rendimiento químico
El reactivo limitante también está relacionado con el rendimiento químico de una reacción. El rendimiento químico es la cantidad real de producto obtenido en comparación con la cantidad teórica máxima que se puede obtener. El rendimiento químico se calcula dividiendo la cantidad real de producto obtenido por la cantidad teórica máxima y multiplicando por 100 para obtener un rendimiento porcentual.
Maximización del aprovechamiento de los reactivos
El conocimiento del reactivo limitante y el rendimiento químico permite maximizar el aprovechamiento de los reactivos y evitar el desperdicio de recursos. Al utilizar la cantidad justa de reactivo limitante, se puede obtener la máxima cantidad de producto posible.
Ejemplos de reactivo limitante
Para comprender mejor el concepto de reactivo limitante, veamos algunos ejemplos:
Ejemplo 1
En la reacción entre el hidrógeno (H2) y el oxígeno (O2) para formar agua (H2O), la ecuación balanceada es:
2H2 + O2 → 2H2O
Si tenemos 4 moles de H2 y 2 moles de O2, podemos determinar el reactivo limitante comparando las cantidades de los reactivos en relación a sus coeficientes estequiométricos. En este caso, el coeficiente de O2 es 1 y el coeficiente de H2 es 2. Por lo tanto, necesitamos 4 moles de O2 para reaccionar con los 4 moles de H2. Como solo tenemos 2 moles de O2, este es el reactivo limitante. Esto significa que solo se pueden formar 2 moles de H2O.
Ejemplo 2
En la reacción entre el cloruro de sodio (NaCl) y el nitrato de plata (AgNO3) para formar cloruro de plata (AgCl) y nitrato de sodio (NaNO3), la ecuación balanceada es:
NaCl + AgNO3 → AgCl + NaNO3
Si tenemos 10 gramos de NaCl y 20 gramos de AgNO3, podemos determinar el reactivo limitante comparando las masas de los reactivos en relación a sus masas molares. La masa molar de NaCl es 58.44 g/mol y la masa molar de AgNO3 es 169.87 g/mol. Calculando las moles de cada reactivo, encontramos que tenemos 0.171 moles de NaCl y 0.118 moles de AgNO3. Como el coeficiente de NaCl es 1 y el coeficiente de AgNO3 es 1, podemos ver que necesitamos la misma cantidad de moles de ambos reactivos para reaccionar. Por lo tanto, en este caso, no hay reactivo limitante y ambos reactivos se consumirán por completo.
Conclusión
El reactivo limitante es crucial en una reacción química, ya que determina la cantidad máxima de producto que se puede obtener. Conociendo el reactivo limitante, es posible realizar cálculos estequiométricos y determinar el rendimiento químico de la reacción. Esto permite maximizar el aprovechamiento de los reactivos y evitar el desperdicio de recursos.