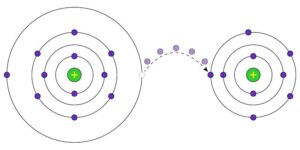
Exploraremos en detalle el concepto de redox, una reacción química fundamental que implica la transferencia de electrones entre diferentes reactivos. Veremos qué es la redox, cómo se produce y qué importancia tiene en diversos campos, como la industria y el tratamiento del agua en piscinas.
La redox, abreviatura de reducción-oxidación, es una reacción química en la que ocurre una transferencia de electrones entre diferentes especies químicas. En estas reacciones, un elemento o compuesto químico pierde electrones (oxidación) y otro los gana (reducción). Esta transferencia de electrones resulta en un cambio en el estado de oxidación de los reactivos involucrados.
¿Qué es la redox?
La redox, abreviatura de reducción-oxidación, es una reacción química en la que ocurre una transferencia de electrones entre diferentes especies químicas. En estas reacciones, un elemento o compuesto químico pierde electrones (oxidación) y otro los gana (reducción). Esta transferencia de electrones resulta en un cambio en el estado de oxidación de los reactivos involucrados.
Concepto de reducción
La reducción es un proceso en el que un elemento o compuesto químico gana electrones, lo que resulta en una disminución de su estado de oxidación. En una reacción redox, la especie química que se reduce se llama agente reductor, ya que facilita la transferencia de electrones a otra especie química.
Por ejemplo, en la reacción:
Fe2+ + 2e– → Fe
El hierro (Fe) se reduce al ganar dos electrones y su estado de oxidación disminuye de +2 a 0.
Concepto de oxidación
La oxidación es un proceso en el que un elemento o compuesto químico pierde electrones, lo que resulta en un aumento de su estado de oxidación. En una reacción redox, la especie química que se oxida se llama agente oxidante, ya que facilita la transferencia de electrones a otra especie química.
Por ejemplo, en la reacción:
2Cl– → Cl2 + 2e–
El cloro (Cl–) se oxida al perder dos electrones y su estado de oxidación aumenta de -1 a 0.
Importancia de la redox
La redox tiene una gran importancia en diversos campos, ya que está involucrada en una amplia gama de procesos químicos y biológicos. Algunas de las aplicaciones más destacadas de la redox son:
Industria
En la industria, el conocimiento de las reacciones redox es esencial para la síntesis de productos químicos y la generación de energía. Por ejemplo, en la producción de aluminio, se utiliza una reacción redox para reducir el óxido de aluminio y obtener aluminio metálico. Además, las pilas y baterías funcionan mediante reacciones redox que permiten la generación y almacenamiento de energía eléctrica.
Tratamiento del agua en piscinas
En el ámbito de las piscinas, el concepto de redox es fundamental para controlar los procesos químicos del agua y garantizar la seguridad de los bañistas. El redox del agua de la piscina se mide mediante un potencial de oxidación-reducción, que indica la capacidad del agua para oxidar o reducir sustancias químicas. Mantener un redox adecuado es crucial para prevenir el crecimiento de bacterias y mantener el agua limpia y saludable.
Ejemplos de reacciones redox
Existen numerosos ejemplos de reacciones redox en la vida cotidiana y en la química. Algunos ejemplos comunes incluyen:
Oxidación del hierro
La oxidación del hierro es un ejemplo clásico de una reacción redox. Cuando el hierro se expone al oxígeno y la humedad del aire, se produce una reacción en la que el hierro se oxida, formando óxido de hierro (óxido férrico). Esta reacción es responsable de la corrosión del hierro y la formación de óxido de hierro rojo conocido como óxido de hierro.
Reducción del oxígeno en la respiración celular
En la respiración celular, el oxígeno actúa como agente oxidante al aceptar electrones de los compuestos orgánicos, como la glucosa. Esta reacción de reducción del oxígeno es esencial para la producción de energía en las células.
Reacciones de combustión
Las reacciones de combustión, como la quema de combustibles fósiles, son ejemplos de reacciones redox en las que se produce una oxidación rápida de un compuesto orgánico, liberando energía en forma de calor y luz.
Conclusión
La redox es una reacción química fundamental que implica la transferencia de electrones entre diferentes reactivos. Esta reacción es importante en diversos campos, como la industria y el tratamiento del agua en piscinas. Comprender el concepto de redox y sus aplicaciones nos permite comprender mejor los procesos químicos y biológicos que ocurren a nuestro alrededor.