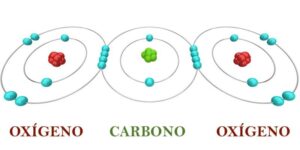
La regla del octeto es una teoría en química que establece que los átomos tienden a completar su último nivel de energía con 8 electrones para alcanzar una configuración electrónica estable, similar a la de los gases nobles. Fue enunciada por Gilbert N. Lewis en 1917. Según esta regla, los elementos de alta electronegatividad tienden a ganar electrones para alcanzar el octeto, mientras que los elementos de baja electronegatividad tienden a perder electrones. Esta regla explica la formación de enlaces químicos y las propiedades de las moléculas resultantes. Sin embargo, existen excepciones a esta regla, como la hipervalencia en algunos átomos y la capacidad del hidrógeno para aceptar hasta dos electrones. La regla del octeto se representa mediante la estructura de Lewis, que utiliza puntos o guiones para representar los electrones compartidos en una molécula y los electrones libres en cada átomo.
¿Qué es la regla del octeto?
La regla del octeto es una teoría en química que establece que los átomos tienden a completar su último nivel de energía con 8 electrones para alcanzar una configuración electrónica estable, similar a la de los gases nobles. Esto se debe a que los átomos buscan alcanzar una mayor estabilidad y menor energía. Al completar su último nivel de energía con 8 electrones, los átomos adquieren una configuración similar a la de los gases nobles, que son altamente estables debido a su configuración electrónica completa.
Concepto de la regla del octeto
El concepto de la regla del octeto se basa en la idea de que los átomos tienden a ganar, perder o compartir electrones para alcanzar una configuración electrónica estable con 8 electrones en su último nivel de energía. Esto se debe a que los átomos con una configuración electrónica completa son más estables y tienen menor energía. Al alcanzar el octeto, los átomos adquieren una mayor estabilidad y menor reactividad, lo que les permite formar enlaces químicos y participar en reacciones químicas.
Significado de la regla del octeto
El significado de la regla del octeto radica en su capacidad para explicar la formación de enlaces químicos y las propiedades de las moléculas resultantes. Según esta regla, los elementos de alta electronegatividad tienden a ganar electrones para alcanzar el octeto, mientras que los elementos de baja electronegatividad tienden a perder electrones. Esto se debe a que los elementos de alta electronegatividad tienen una mayor atracción por los electrones, lo que les permite ganar electrones de otros átomos para completar su octeto. Por otro lado, los elementos de baja electronegatividad tienen una menor atracción por los electrones, lo que les permite perder electrones y alcanzar el octeto.
Excepciones a la regla del octeto
Aunque la regla del octeto es una regla general que se cumple en la mayoría de los casos, existen algunas excepciones a esta regla. Algunas de las excepciones más comunes son:
Hipervalencia
La hipervalencia se refiere a la capacidad de algunos átomos, como el fósforo, el azufre y el cloro, de formar enlaces químicos en los que superan el octeto y tienen más de 8 electrones en su último nivel de energía. Esto se debe a que estos átomos tienen orbitales d y f vacíos que les permiten aceptar electrones adicionales y formar enlaces químicos más allá del octeto.
Hidrógeno
A diferencia de otros elementos, el hidrógeno puede alcanzar la estabilidad con solo 2 electrones en su último nivel de energía. Esto se debe a que el hidrógeno solo tiene un orbital 1s, que solo puede contener un máximo de 2 electrones. Por lo tanto, el hidrógeno puede aceptar hasta dos electrones para alcanzar su configuración electrónica estable.
Ejemplos de la regla del octeto
La regla del octeto se puede aplicar a diferentes elementos y compuestos químicos. Algunos ejemplos de la regla del octeto son:
Enlace iónico
En el enlace iónico, los elementos de alta electronegatividad tienden a ganar electrones para alcanzar el octeto, mientras que los elementos de baja electronegatividad tienden a perder electrones. Por ejemplo, en el compuesto de cloruro de sodio (NaCl), el sodio (Na) pierde un electrón y el cloro (Cl) gana un electrón, lo que permite que ambos átomos alcancen el octeto.
Enlace covalente
En el enlace covalente, los átomos comparten electrones para alcanzar el octeto. Por ejemplo, en el compuesto de agua (H2O), el oxígeno (O) comparte electrones con los dos átomos de hidrógeno (H), lo que permite que todos los átomos alcancen el octeto.
Enlace metálico
En el enlace metálico, los átomos de metal comparten electrones en una «nube» de electrones, lo que permite que todos los átomos alcancen el octeto. Por ejemplo, en el metal de cobre (Cu), los átomos de cobre comparten electrones en una «nube» de electrones, lo que les permite alcanzar el octeto.
Conclusión
La regla del octeto es una teoría en química que establece que los átomos tienden a completar su último nivel de energía con 8 electrones para alcanzar una configuración electrónica estable. Esta regla explica la formación de enlaces químicos y las propiedades de las moléculas resultantes. Aunque existen excepciones a esta regla, como la hipervalencia en algunos átomos y la capacidad del hidrógeno para aceptar hasta dos electrones, la regla del octeto es una regla general que se cumple en la mayoría de los casos.