La termoquímica es una rama de la termodinámica que se encarga de estudiar los intercambios de energía que ocurren durante una reacción química. Exploraremos en detalle qué es la termoquímica, cómo se aplica en la física y la química, y cuáles son sus principales conceptos y aplicaciones.
La termoquímica es una disciplina que combina los principios de la termodinámica y la química para comprender los cambios energéticos que tienen lugar en las reacciones químicas. A través del estudio de la termoquímica, podemos determinar la cantidad de energía que se libera o se absorbe durante una reacción, lo que nos permite predecir la viabilidad y la dirección de dicha reacción.
¿Qué es la termoquímica?
La termoquímica es el área de la termodinámica que se dedica al estudio de los intercambios de energía producidos en el marco de una reacción química. Se basa en los principios de la termodinámica y examina los procesos endotérmicos (absorción de calor) y exotérmicos (liberación de calor) que ocurren durante una reacción química.
La termoquímica nos permite comprender cómo los cambios en la energía afectan a las reacciones químicas y cómo se pueden utilizar estos conocimientos para optimizar los procesos químicos y mejorar la eficiencia energética.
Principios de la termoquímica
En la termoquímica, se utilizan los siguientes principios de la termodinámica:
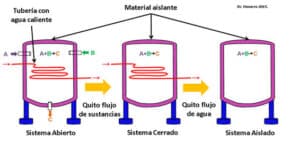
- Primer principio de la termodinámica: establece que la energía total de un sistema aislado se conserva, es decir, la energía no se crea ni se destruye, solo se transforma. Este principio se conoce como el principio de conservación de la energía.
- Segundo principio de la termodinámica: establece que la entropía de un sistema aislado siempre tiende a aumentar. La entropía es una medida del desorden o la distribución de la energía en un sistema. Este principio se conoce como el principio de la entropía.
Estos principios son fundamentales para comprender cómo se producen los cambios energéticos en las reacciones químicas y cómo se pueden predecir y controlar.
Conceptos clave en termoquímica
Entalpía
La entalpía es una función termodinámica que representa la suma de la energía interna de un cuerpo más el producto de la presión externa por su volumen. Se denota como H y se expresa en unidades de energía, como julios (J) o calorías (cal).
La entalpía es una medida de la cantidad de energía que se libera o se absorbe durante una reacción química. Si la entalpía es negativa, significa que la reacción es exotérmica y se libera energía en forma de calor. Si la entalpía es positiva, significa que la reacción es endotérmica y se absorbe energía del entorno.
Reacciones exotérmicas y endotérmicas
Las reacciones químicas pueden ser clasificadas como exotérmicas o endotérmicas, dependiendo de si liberan o absorben calor, respectivamente.
En una reacción exotérmica, la energía de los productos es menor que la energía de los reactivos, lo que significa que se libera energía en forma de calor. Un ejemplo de una reacción exotérmica es la combustión de la gasolina en un automóvil.
En una reacción endotérmica, la energía de los productos es mayor que la energía de los reactivos, lo que significa que se absorbe energía del entorno. Un ejemplo de una reacción endotérmica es la fotosíntesis en las plantas, donde se absorbe energía del sol para convertirla en energía química.
Variables de estado en termoquímica
Las variables de estado en la termoquímica son las propiedades que describen el estado de un sistema químico. Estas variables incluyen:
- Temperatura: medida de la energía cinética promedio de las partículas de un sistema. Se expresa en grados Celsius (°C) o kelvin (K).
- Presión: fuerza ejercida por un gas sobre las paredes del recipiente que lo contiene. Se expresa en unidades de presión, como atmósferas (atm) o pascales (Pa).
- Volumen: espacio ocupado por un sistema. Se expresa en unidades de volumen, como litros (L) o metros cúbicos (m³).
- Densidad: masa de un sistema dividida por su volumen. Se expresa en unidades de densidad, como gramos por centímetro cúbico (g/cm³) o kilogramos por metro cúbico (kg/m³).
- Entropía: medida del desorden o la distribución de la energía en un sistema. Se expresa en unidades de entropía, como julios por kelvin (J/K) o calorías por kelvin (cal/K).
- Energía libre de Gibbs: medida de la energía disponible para realizar trabajo en un sistema. Se expresa en unidades de energía, como julios (J) o calorías (cal).
- Polarización: fenómeno en el que las cargas eléctricas se distribuyen de manera asimétrica en una molécula o un material. Se expresa en unidades de polarización, como culombios por metro cuadrado (C/m²) o dipolos por metro cuadrado (D/m²).
Estas variables de estado son fundamentales para describir y predecir los cambios energéticos que ocurren en las reacciones químicas.
Aplicaciones de la termoquímica
La termoquímica tiene diversas aplicaciones en diferentes campos, entre ellos:
Industria
La termoquímica se utiliza en la producción de energía, como en la generación de electricidad a partir de combustibles fósiles. También se aplica en la producción de materiales y productos químicos, como la síntesis de plásticos y la fabricación de productos farmacéuticos.
Investigación biológica
La termoquímica se aplica en el estudio de las reacciones químicas que ocurren en los organismos vivos, como el metabolismo. Permite comprender cómo se producen y se regulan las reacciones químicas en los seres vivos, lo que es fundamental para el desarrollo de medicamentos y tratamientos médicos.
Química orgánica
La termoquímica se utiliza para determinar la energía de enlace en las moléculas orgánicas y predecir la estabilidad de los compuestos. Esto es importante para el diseño y la síntesis de nuevos compuestos químicos, así como para comprender las propiedades y el comportamiento de los compuestos orgánicos.
Medio ambiente
La termoquímica se utiliza en el estudio de los procesos de combustión y la generación de energía renovable. Permite evaluar la eficiencia y el impacto ambiental de los procesos de combustión, así como desarrollar tecnologías más limpias y sostenibles para la generación de energía.
Ejemplos de termoquímica
Algunos ejemplos de aplicaciones de la termoquímica son:
- La combustión de la gasolina en un automóvil es un ejemplo de una reacción exotérmica en la que se libera energía en forma de calor. Esta energía se utiliza para mover el automóvil y realizar trabajo mecánico.
- La fotosíntesis en las plantas es un ejemplo de una reacción endotérmica en la que se absorbe energía del sol para convertirla en energía química. Esta energía se utiliza para alimentar los procesos metabólicos de las plantas.
- La descomposición del peróxido de hidrógeno en agua y oxígeno es un ejemplo de una reacción exotérmica en la que se libera calor. Esta reacción se utiliza en los kits de blanqueamiento dental para liberar oxígeno y eliminar las manchas de los dientes.
Conclusión
La termoquímica es una rama de la termodinámica que se encarga de estudiar los intercambios de energía que ocurren durante una reacción química. A través de la aplicación de los principios de la termodinámica, la termoquímica nos permite comprender y predecir los cambios energéticos que tienen lugar en las reacciones químicas. Además, tiene diversas aplicaciones en la industria, la investigación biológica y la química orgánica, entre otros campos.